Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
千葉 薫*; 松井 拓郎*; 茶竹 俊行*; 大原 高志; 田中 伊知朗*; 油谷 克英*; 新村 信雄*
Protein Science, 32(10), p.e4765_1 - e4765_13, 2023/10
被引用回数:0 パーセンタイル:0(Biochemistry & Molecular Biology)In structural biology, peptide bonds, fundamental linkages between hundreds of amino acids, of which a protein molecule is composed, have been commonly treated as a plane structure just as Linus Pauling et al. proposed. In this paper, a site-specific peptide bond relaxation mechanism by deuterons whose localization has been suggested by neutron crystallography is proposed. A comprehensive study using X-ray and neutron diffraction and 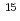 N chemical shifts of individual amide nitrogen atoms within the same peptide bond strongly suggests the relaxation of the electronic resonance structure because of site-specific modulation by protons/deuterons localized on the electron orbital of the carbonyl oxygen.
N chemical shifts of individual amide nitrogen atoms within the same peptide bond strongly suggests the relaxation of the electronic resonance structure because of site-specific modulation by protons/deuterons localized on the electron orbital of the carbonyl oxygen.
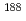 Re biomolecules via EHDP
Re biomolecules via EHDPFerro-Flores, G.*; Garcia-Salinas, L.*; Paredes-Gutierrez, L.*; 橋本 和幸; Melendes-Alafort, L.*; Murphy, C. A.*
IAEA-TECDOC-1228, p.99 - 103, 2001/06
がん治療用RIのキャリアーとして注目されている数種の生体分子(モノクローナル抗体、そのF(ab') フラグメント、ペプチド等)の
フラグメント、ペプチド等)の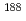 Re標識化について、中間体を生成するための配位子(Weak competing ligand)を用いて検討を行った。配位子としては、ヒドロキシエチリデンジホスホン酸(EHDP)を用いた。標識条件として、pH、温度、配位子濃度、レニウムの還元剤である塩化スズ濃度等を変化させて、生体分子への
Re標識化について、中間体を生成するための配位子(Weak competing ligand)を用いて検討を行った。配位子としては、ヒドロキシエチリデンジホスホン酸(EHDP)を用いた。標識条件として、pH、温度、配位子濃度、レニウムの還元剤である塩化スズ濃度等を変化させて、生体分子への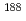 Re標識率の変化を詳しく調べた。その結果、90%以上の高い標識率を得るためには、レニウムを還元(Re(VII)
Re標識率の変化を詳しく調べた。その結果、90%以上の高い標識率を得るためには、レニウムを還元(Re(VII)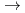 Re(V),Re(IV))するために還元剤の酸性条件(pH3)及び高濃度の塩化スズが必要であることが明らかになった。また、
Re(V),Re(IV))するために還元剤の酸性条件(pH3)及び高濃度の塩化スズが必要であることが明らかになった。また、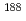 Re標識生体分子の免疫活性は、標識後も保持されていることが確かめられた。さらに得られた標識生体分子の安定性及びマウスを用いた体内導態についても検討した。
Re標識生体分子の免疫活性は、標識後も保持されていることが確かめられた。さらに得られた標識生体分子の安定性及びマウスを用いた体内導態についても検討した。
浅野 雅春; 吉田 勝; 大道 英樹; 山中 英寿*
マテリアルライフ, 6(1), p.10 - 23, 1994/01
機能性を付与したバイオメディカルポリマーの開発の中で、ドラッグ・デリバリーシステム(DDS)用高分子材料の占める割合は大きくなってきている。その中でも、生体内で分解する高分子はDDS用薬物担体として最近特に注目されている。本論文では、ポリペプチド、ポリエステル、ポリデプシペプチドなどの生体分解性高分子を設計・合成してきた立場から、医学・薬学分野の協力を得て検討してきた研究成果を中心に、生体分解性高分子のDDS用薬物担体としての可能性について述べている。
浅野 雅春; 吉田 勝; 大道 英樹; 山中 英寿*
膜, 17(4), p.216 - 227, 1992/07
ポリマー主鎖中にアミド結合(-NHCO-)あるいはエステル結合(-COO-)をもつポリペプチド, ポリオキシ酸, ポリラクトン, ポリデプシペプチドなどの生体分解性ポリマーを合成し、それらのポリマーの分解特性(生体内での)を検討した。また、制癌薬, ホルモンなどの薬物とポリマーを複合化する技術の確立、さらに得られた複合体からの薬物のin vivo放出制御、そして埋入型複合体の性能評価についても検討した。本研究は、それらの研究成果を「総説」としてまとめたものである。
吉田 勝; 桜井 靖夫*; 玉田 正男; 熊倉 稔*; 萩原 幸; 片貝 良一*
Radiation Physics and Chemistry, 39(6), p.469 - 472, 1992/00
L-Ala-GlyoEt,L-Val-GlyoEt,L-Leu-GlyoEt,L-ILe-GlyoEtの側鎖シーケンスをもつポリメタクリロイルヒドロゲルを合成し、溶媒の種類と温度変化に対する応答性を調べた。いずれのヒドロゲルでも10 Cでの膨潤率は、30%水-70%2-プロパノールのときに極大を示した。また、極大値はL-ILe-GlyoEt
Cでの膨潤率は、30%水-70%2-プロパノールのときに極大を示した。また、極大値はL-ILe-GlyoEt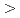 L-Leu-GlyoEt
L-Leu-GlyoEt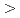 L-Val-GlyoEt
L-Val-GlyoEt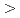 L-Ala-GlyoEtの順に増加した。L-ILe-GlyoEtを含むヒドロゲルを用いて、温度応答性を調べたところ低温で膨潤し高温で収縮する性質を示した。
L-Ala-GlyoEtの順に増加した。L-ILe-GlyoEtを含むヒドロゲルを用いて、温度応答性を調べたところ低温で膨潤し高温で収縮する性質を示した。
 -hydroxy acids as biodegradable carriers
-hydroxy acids as biodegradable carriers吉田 勝; 浅野 雅春; 熊倉 稔; 片貝 良一*; 真下 透*; 湯浅 久子*; 山中 英寿*
European Polymer Journal, 27(3), p.325 - 329, 1991/00
被引用回数:14 パーセンタイル:59.11(Polymer Science)L-アラニル-L-アミノアシル- -エチルL-グルタミル-L-ヒドロキシル[Ala-AA-Glu(oEf)-HA]のシーケンスをもつ生分解生ポリデプシペプチドを合成し、酵素作用による分解メカニズムを検討した。酵素作用による分解性とそれの分解パターンはシーケンス中のAAおよびHAユニットの側鎖基のサイズに強く依存する。例えば、Ala-Ala-Glu(oEf)-HAシーケンスにおいて、HAユニットとしてL-ロイシン酸の導入はS-字型分解パターンとなり、対照的に放物線型分解パターンはグリコール酸の導入によって出現する。また、酵素作用の違いから、Ala-AA-Glu(oEf)-HAのシーケンスをもつポリデプシペプチドの分解が、プロテアーゼ酵素(ペプチド結合を切断)によりむしろエステラーゼ酵素(エステル結合を切断)によって加水分解を受けやすいことが分かった。
-エチルL-グルタミル-L-ヒドロキシル[Ala-AA-Glu(oEf)-HA]のシーケンスをもつ生分解生ポリデプシペプチドを合成し、酵素作用による分解メカニズムを検討した。酵素作用による分解性とそれの分解パターンはシーケンス中のAAおよびHAユニットの側鎖基のサイズに強く依存する。例えば、Ala-Ala-Glu(oEf)-HAシーケンスにおいて、HAユニットとしてL-ロイシン酸の導入はS-字型分解パターンとなり、対照的に放物線型分解パターンはグリコール酸の導入によって出現する。また、酵素作用の違いから、Ala-AA-Glu(oEf)-HAのシーケンスをもつポリデプシペプチドの分解が、プロテアーゼ酵素(ペプチド結合を切断)によりむしろエステラーゼ酵素(エステル結合を切断)によって加水分解を受けやすいことが分かった。
吉田 勝; 鈴木 靖人*; 玉田 正男; 熊倉 稔*; 片貝 良一*
European Polymer Journal, 27(6), p.493 - 499, 1991/00
被引用回数:14 パーセンタイル:59.11(Polymer Science)L-アミノアシル-L-アラニンエチルエステルのシーケンス(AA-Ala-oEt)をもつメタクリロイルジペプチドをシクロヘキシルカルボジイミドを介した縮合法により合成し、さらに重合させることによりポリマーゲルを得た。水系および水-メタノール系を用いて、ゲルの温度変化に対する応答性を調べたところ、いずれの溶媒系においても、可逆的な低温膨潤-高温収縮の応答性を示すことが分かった。この場合、ゲルの温度応答性は、側鎖基としてGly-Ala-oEt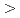 Ala-Ala-oEt
Ala-Ala-oEt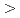 Val-Ala-oEt
Val-Ala-oEt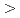 ILe-Ala-oEtの順に増加した(Gly:グリシン、Val:L-バリン、ILe:イソロイシン)。電子顕微鏡観察から、このゲルは低温膨潤時においてhoneycomb構造の空孔を形成し、高温収縮時で、ゲル表面にrigid membrane barrierを形成することを特徴とすることが明らかとなった。
ILe-Ala-oEtの順に増加した(Gly:グリシン、Val:L-バリン、ILe:イソロイシン)。電子顕微鏡観察から、このゲルは低温膨潤時においてhoneycomb構造の空孔を形成し、高温収縮時で、ゲル表面にrigid membrane barrierを形成することを特徴とすることが明らかとなった。
吉田 勝; 浅野 雅春; 熊倉 稔; 片貝 良一*; 真下 透*; 湯浅 久子*; 今井 強一*; 山中 英寿*
Colloid and Polymer Science, 268(8), p.726 - 730, 1990/00
被引用回数:8 パーセンタイル:43.19(Chemistry, Physical)L-アラニル-L-アラニル- -エテル-L-グルタミル-L-ラクテル(AlaAlaGlu(oE
-エテル-L-グルタミル-L-ラクテル(AlaAlaGlu(oE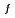 )Lac)の繰り返しからなるポリマーを合成し、このポリマーの粒子化を溶媒蒸発法で検討した。ポリマー(200mg)を含むクロロホルム/ジクロロ酢酸(98/2%)溶液(10ml)を1%ポリビニルアルコール水溶液(200ml)にそそぎ、30
)Lac)の繰り返しからなるポリマーを合成し、このポリマーの粒子化を溶媒蒸発法で検討した。ポリマー(200mg)を含むクロロホルム/ジクロロ酢酸(98/2%)溶液(10ml)を1%ポリビニルアルコール水溶液(200ml)にそそぎ、30 C400rpmで攪拌した時、58
C400rpmで攪拌した時、58 m径の球状粒子を得た。この場合、系中のジクロロ酢酸は粒子形成に最も重要な役割を果たす。一方、AlaAlaGlu(oE
m径の球状粒子を得た。この場合、系中のジクロロ酢酸は粒子形成に最も重要な役割を果たす。一方、AlaAlaGlu(oE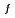 )Lacポリマーは、その主鎖にエステル結合とペプチド結合をもつため、エステラーゼ酵素とプロテアーゼ酵素作用によって分解を受けることが期待される。ポリマー粒子をウイスター系ラットの背中皮下に埋め込み、その分解性を調べたところ、25週目で完全に分解消失することが分かった。この粒子に薬物を包括し、粒子からの薬物の放出性及びラット前立腺におよぼす薬理作用も同時に調べた。
)Lacポリマーは、その主鎖にエステル結合とペプチド結合をもつため、エステラーゼ酵素とプロテアーゼ酵素作用によって分解を受けることが期待される。ポリマー粒子をウイスター系ラットの背中皮下に埋め込み、その分解性を調べたところ、25週目で完全に分解消失することが分かった。この粒子に薬物を包括し、粒子からの薬物の放出性及びラット前立腺におよぼす薬理作用も同時に調べた。
吉田 勝; 浅野 雅春; 熊倉 稔; 片貝 良一*; 真下 透*; 湯浅 久子*; 今井 強一*; 山中 英寿*
J. Biomed. Mater. Res., 24, p.1173 - 1184, 1990/00
被引用回数:32 パーセンタイル:75.14(Engineering, Biomedical)アミノ酸とオキシ酸からなるシーケンシャルポリデプシペプチドは主鎖にペプチド結合(-CONH-)とエステル結合(-COO-)をもつため、プロテアーゼ酵素とエステラーゼ酵素の競争反応によって分解を受けることが期待できる。この目的に対し、我々は、アミノ酸とオキシ酸による2-ニトロフェニルN-カルボキシアンヒドライド法を用いて、(L-アラニル)n- -エチルレーグルタメート-L-ラクチル、[(Ala)
-エチルレーグルタメート-L-ラクチル、[(Ala)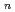 -Glu(OEt)-Lac]、シーケンスからなるポリマーを合成した(n=0,1,2,3)。これらのポリマーに対する酵素分解作用は、エステル結合に作用するエステラーゼの方がペプチド結合に作用するプロテアーゼよりおおきいことが分った。この場合、リゾプスデレマー起源のリパーゼが最も強い酵素分解作用を示した。この酵素を用いた時、Ala-Ala-Glu(OEt)-Lacシーケンスポリマーが最も分解されやすかった。
-Glu(OEt)-Lac]、シーケンスからなるポリマーを合成した(n=0,1,2,3)。これらのポリマーに対する酵素分解作用は、エステル結合に作用するエステラーゼの方がペプチド結合に作用するプロテアーゼよりおおきいことが分った。この場合、リゾプスデレマー起源のリパーゼが最も強い酵素分解作用を示した。この酵素を用いた時、Ala-Ala-Glu(OEt)-Lacシーケンスポリマーが最も分解されやすかった。
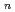 -L-lactyl sequences(n=0,1,2, and 3)
-L-lactyl sequences(n=0,1,2, and 3)吉田 勝; 浅野 雅春; 熊倉 稔; 片貝 良一*; 真下 透*; 湯浅 久子*; 今井 強一*; 山中 英寿*
Makromol. Chem. Rapid Commun., 11, p.337 - 343, 1990/00
(L-アラニル)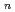 -L-ラクチル[(Ala)
-L-ラクチル[(Ala)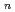 -Lac](n=0-3)単位からなるシーケンシャルポリデプシペプチドを2-ニトロフェニルサルフェニルN-カルボキシ酸無水物法によって合成した。このポリマーは主鎖にペプチド結合とエステル結合をもつため、プロテアーゼ酵素(例、トリプシン)とエステラーゼ酵素(例、リパーゼ)の競争反応によって分解を受けることが考えられる。トリプシンによるポリマーの分解は、poly(Ala-Lac)で極大を示し、試験開始から10週目で約55%分解率に達した。同じ傾向はリパーゼを用いた時にも観察された。しかし、分解率は、トリプシンのそれより著しく高く、100%近くにまで達することが分かった。この結果は、エステル結合を切断する酵素作用によってポリマーの分解が優先的に起こっていることを意味する。
-Lac](n=0-3)単位からなるシーケンシャルポリデプシペプチドを2-ニトロフェニルサルフェニルN-カルボキシ酸無水物法によって合成した。このポリマーは主鎖にペプチド結合とエステル結合をもつため、プロテアーゼ酵素(例、トリプシン)とエステラーゼ酵素(例、リパーゼ)の競争反応によって分解を受けることが考えられる。トリプシンによるポリマーの分解は、poly(Ala-Lac)で極大を示し、試験開始から10週目で約55%分解率に達した。同じ傾向はリパーゼを用いた時にも観察された。しかし、分解率は、トリプシンのそれより著しく高く、100%近くにまで達することが分かった。この結果は、エステル結合を切断する酵素作用によってポリマーの分解が優先的に起こっていることを意味する。
 -ethyl L-glutamate and an
-ethyl L-glutamate and an  -hydroxy acid L-lactic acid or
-hydroxy acid L-lactic acid or  -amino acid L-alanine
-amino acid L-alanine浅野 雅春; 吉田 勝; 嘉悦 勲; 片貝 良一*; 真下 透*; 湯浅 久子*; 今井 強一*; 山中 英寿*
Polym. J., 20(3), p.281 - 284, 1988/00
被引用回数:7 パーセンタイル:71.96(Polymer Science)ペプチド結合とエステル結合をもつシーケンシャルポリデプシペプチド、〔Ala-Leu-Glu(OEt)-Lac〕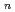 とペプチド結合のみをもつシーケンシャルポリペプチド、〔Ala-Leu-Glu(OEt)-Ala〕
とペプチド結合のみをもつシーケンシャルポリペプチド、〔Ala-Leu-Glu(OEt)-Ala〕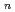 を合成した。これらのポリマーの酵素分解性を検討した。
を合成した。これらのポリマーの酵素分解性を検討した。
嘉悦 勲; 吉田 勝; 浅野 雅春; 久保 長生*; 嘉多村 孝一*; 大川 智彦*; 牧田 登之*; 今井 強一*; 真下 透*; 湯浅 久子*; et al.
人工臓器, 15(1), p.210 - 213, 1986/00
制癌剤含有ポリマー複合体を癌組織に投与した場合、薬物の組織浸透により壊死が起るが、その範囲が限定されているため、これを拡大するために、新しい担体ポリマーと薬物及びadditiveなどの組合せの検討を行なった。その結果、ラットの正常肝組織に対しては、シスプラティンを含有したDL-アラニン/ -エチル-L-アスパラテートコポリマーの複合体が薬物滲透、組織壊死の両面で最も良好であることがわかった。次いで、この系を担癌動物にも使用して有効性をしらべたところ、顕著な壊死効果が認められた。コポリペプチド以外の生体消化性ポリマーについても、担体としての効果を検討し、消化性の速いものほど有効であることを認めた。
-エチル-L-アスパラテートコポリマーの複合体が薬物滲透、組織壊死の両面で最も良好であることがわかった。次いで、この系を担癌動物にも使用して有効性をしらべたところ、顕著な壊死効果が認められた。コポリペプチド以外の生体消化性ポリマーについても、担体としての効果を検討し、消化性の速いものほど有効であることを認めた。
浅野 雅春; 吉田 勝; 嘉悦 勲; 片貝 良一*; 今井 強一*; 真下 透*; 湯浅 久子*; 山中 英寿*
生体材料, 3(2), p.85 - 94, 1985/00
アミノ酸とオキシ酸からなるsequential polydepsipeptide,[AlaAlaGlu(OEt)Lac]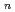 を合成し、melt-pressingによって高密度の円柱状担体(1.6mm径)に成形加工した。そして、この担体のdrug delivery systemへの適用性の評価をin vitro-in vivo実験においておこなった。担体の酵素分解はアミノ酸分解酵素によるよりも、むしろエステル分解酵素による作用の方が顕著であった。また、アミノ酸分析のデーターから、担体中のAlanine moietyの分解消費速度がGlutamic acid moietyのそれより早いことも分った。一方、この担体のin vivo分解は24Wで100%分解消失した。同じ担体に
を合成し、melt-pressingによって高密度の円柱状担体(1.6mm径)に成形加工した。そして、この担体のdrug delivery systemへの適用性の評価をin vitro-in vivo実験においておこなった。担体の酵素分解はアミノ酸分解酵素によるよりも、むしろエステル分解酵素による作用の方が顕著であった。また、アミノ酸分析のデーターから、担体中のAlanine moietyの分解消費速度がGlutamic acid moietyのそれより早いことも分った。一方、この担体のin vivo分解は24Wで100%分解消失した。同じ担体に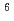
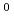 Co線源からの
Co線源からの 線を1Mrad照射した場合、100%分解は28Wに延長された。しかし、5Mrad照射した時、担体中に酵素未分解moiety(20%)の生成が認められた。このmoietyは空気中で照射した時の方が、さらに増加傾向を示した。このような照射効果について、詳しく検討した。
線を1Mrad照射した場合、100%分解は28Wに延長された。しかし、5Mrad照射した時、担体中に酵素未分解moiety(20%)の生成が認められた。このmoietyは空気中で照射した時の方が、さらに増加傾向を示した。このような照射効果について、詳しく検討した。
 -benzyl L-aspartate and
-benzyl L-aspartate and  -methyl L-glutamate for the controlled release of testosterone
-methyl L-glutamate for the controlled release of testosterone浅野 雅春; 吉田 勝; 嘉悦 勲; 山中 英寿*; 志田 圭三*
Makromol.Chem., 184(9), p.1761 - 1770, 1983/00
B-bzL-Asp/ -MeL-Gluのランダムコポリマーを合成し、ラットの皮下に埋入した。このコポリマーはin vivo消化性を有し、かつ生体適合性に優れていることが分った。この結果に基づいて、コポリ(B-bzL-Asp/
-MeL-Gluのランダムコポリマーを合成し、ラットの皮下に埋入した。このコポリマーはin vivo消化性を有し、かつ生体適合性に優れていることが分った。この結果に基づいて、コポリ(B-bzL-Asp/ -MeL-Glu)をdrug delivery systemに対する担体として用いることを試みた。テストステロン/ポリマー複合体は微量のdichloroethane存在下、200kg/cm
-MeL-Glu)をdrug delivery systemに対する担体として用いることを試みた。テストステロン/ポリマー複合体は微量のdichloroethane存在下、200kg/cm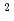 の圧力下で試作した。複合体からのテストステロンのin vivo溶出速度はin vitroより約5.5倍大きかった。この場合、in vivo溶出速度は90日間にわたって一定値(0.22mg/day)を示した。去勢ラットに達するserum薬物濃度は0.40ng/mlであったが、複合体埋入系のそれは6.8ng/mlであった。
の圧力下で試作した。複合体からのテストステロンのin vivo溶出速度はin vitroより約5.5倍大きかった。この場合、in vivo溶出速度は90日間にわたって一定値(0.22mg/day)を示した。去勢ラットに達するserum薬物濃度は0.40ng/mlであったが、複合体埋入系のそれは6.8ng/mlであった。
吉田 勝; 浅野 雅春; 嘉悦 勲; 大屋 正尚*
高分子論文集, 39(4), p.285 - 291, 1982/00
被引用回数:10 パーセンタイル:54.32(Polymer Science)N-カルボキシ- -アミノ酸無水物を重合後、ポリマー溶液にテストステロンを含有させ加圧下でテストステロンを含むポリペプチド複合体を調製した。このようにして作ったポリ(
-アミノ酸無水物を重合後、ポリマー溶液にテストステロンを含有させ加圧下でテストステロンを含むポリペプチド複合体を調製した。このようにして作ったポリ( -ベンジル-L-グルタメート)複合体からのin vivoにおけるテストステロンの溶出を検討した結果、時間と累積溶出量の関係を量対数プロットした曲線は溶出開始後2-60日の期間において直線的な増加傾向を示すことが認められた。また、in vivoにおけるポリペプチドの消化性とポリペプチドからのテストステロンの溶出との間の関係は去勢ラットにポリペプチド複合体を埋め込むことによって検討した。30日間埋め込み後、ポリペプチドは約9.5%消化を受け、そのときのテストステロンの累積溶出量は15.2mgに達した。一方、複合体中に包含したテストステロンのin vivoにおける薬理機能(physiological response)は前立腺腹葉の重量変化と血中テストステロン濃度から検討した。
-ベンジル-L-グルタメート)複合体からのin vivoにおけるテストステロンの溶出を検討した結果、時間と累積溶出量の関係を量対数プロットした曲線は溶出開始後2-60日の期間において直線的な増加傾向を示すことが認められた。また、in vivoにおけるポリペプチドの消化性とポリペプチドからのテストステロンの溶出との間の関係は去勢ラットにポリペプチド複合体を埋め込むことによって検討した。30日間埋め込み後、ポリペプチドは約9.5%消化を受け、そのときのテストステロンの累積溶出量は15.2mgに達した。一方、複合体中に包含したテストステロンのin vivoにおける薬理機能(physiological response)は前立腺腹葉の重量変化と血中テストステロン濃度から検討した。
渡辺 宏; 佐藤 友太郎*
Agricultural and Biological Chemistry, 45(5), p.1215 - 1221, 1981/00
放射線抵抗性細菌を溶解する精製P2-2酵素の性質とその溶解作用について検討した。酵素反応の至適温度は60 Cであり、至適pHは8.5であった。本酵素は中性緩衝液中では40
Cであり、至適pHは8.5であった。本酵素は中性緩衝液中では40 Cまで安定であるが、80
Cまで安定であるが、80 C15分の加熱で失活した。 2価金属イオンとPCMBやIAAは酵素活性を阻害した。Sephadex G-75から求めた分子量は16000である。M.radioduransやM.lysodeikticusの細胞壁から調製したペプチドグリカンはP2-2酵素によって溶解し、Freeのアミノ基を遊離するが、還元基やN-アセチルアミノ糖は遊離しなかった。従って本酵素はendopeptidaseであると考えられる。さらに、酵素を作用させたペプチドグリカンのN末端アミノ酸の分析結果から、P2-2酵素はペプチドグリカン中のD-アラニンのカルボキシル基側ペプチド結合を切断すると考えられる。
C15分の加熱で失活した。 2価金属イオンとPCMBやIAAは酵素活性を阻害した。Sephadex G-75から求めた分子量は16000である。M.radioduransやM.lysodeikticusの細胞壁から調製したペプチドグリカンはP2-2酵素によって溶解し、Freeのアミノ基を遊離するが、還元基やN-アセチルアミノ糖は遊離しなかった。従って本酵素はendopeptidaseであると考えられる。さらに、酵素を作用させたペプチドグリカンのN末端アミノ酸の分析結果から、P2-2酵素はペプチドグリカン中のD-アラニンのカルボキシル基側ペプチド結合を切断すると考えられる。
佐々木 一郎; 花岡 宏史*; 山田 圭一*; 渡辺 茂樹; 須郷 由美; 大島 康宏; 石岡 典子
no journal, ,
生理活性ペプチドは、標的分子への特異性が高いことから分子標的治療薬として期待されているが、標的分子への特異的親和性および生体内での安定性を兼ね備えたペプチドの有効な選抜方法がないことから、薬剤開発が思うように進んでいない。そこで、標的分子に親和性を有するペプチドを感度よく選抜するため、生体内での安定性が期待できるD体アミノ酸由来ペプチドに放射性同位元素(RI)を標識したライブラリーを開発し、新規な医薬品候補化合物の選抜法の考案を計画した。本発表では、選抜法を評価するために、様々ながんに過剰発現するHER2 (ヒト上皮成長因子受容体)を標的分子に選び、ペプチドライブラリーの作製・RI標識・バインディングアッセイを実施した。ペプチド配列中のアミノ酸2残基を固定化し、4残基をランダム化したペプチドライブラリーを18種類のアミノ酸を用いて合成し、N末端に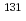 I標識が可能なD体チロシン(y)を導入したペプチドライブラリー(y(3-
I標識が可能なD体チロシン(y)を導入したペプチドライブラリー(y(3-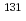 I)-A
I)-A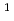 -A
-A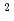 -X
-X -X
-X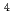 -X
-X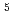 -X
-X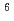 , A:固定, X:ランダム)を作製した。バインディングアッセイの結果、yIIXXXX(固定位置にイソロイシンが二つ配列したライブラリー)がHER2過剰発現細胞株に高い親和性(38-47%dose)を示した。一方、他のライブラリーは低い親和性(約1%dose)を示した。以上より、
, A:固定, X:ランダム)を作製した。バインディングアッセイの結果、yIIXXXX(固定位置にイソロイシンが二つ配列したライブラリー)がHER2過剰発現細胞株に高い親和性(38-47%dose)を示した。一方、他のライブラリーは低い親和性(約1%dose)を示した。以上より、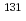 I標識ペプチドライブラリーを用いることで、がん細胞に特異的親和性を持つペプチド医薬品候補化合物が選抜できる可能性が示唆された。
I標識ペプチドライブラリーを用いることで、がん細胞に特異的親和性を持つペプチド医薬品候補化合物が選抜できる可能性が示唆された。
佐々木 一郎; 花岡 宏史*; 山田 圭一*; 渡辺 茂樹; 須郷 由美; 大島 康宏; 石岡 典子
no journal, ,
生理活性ペプチドは、標的分子への親和性や特異性が高いことから分子標的治療薬として期待されているが、標的分子への特異的親和性及び生体内での安定性を兼ね備えたペプチドの有効な選抜方法がないことから、薬剤開発が思う様に進んでいない。そこで、標的分子に親和性を有するペプチドを感度よく選抜するため、生体内での安定性が期待できるD体アミノ酸由来ペプチドに放射性同位元素(RI)を標識したライブラリーを開発し、新規な医薬品候補化合物の選抜法の開発を計画した。本発表では、選抜法を評価するために、様々ながんに過剰発現するHER2(ヒト上皮成長因子受容体)を標的分子に選び、RI標識ペプチドライブラリーの作製及び細胞結合実験を実施した。配列中の2残基のアミノ酸を固定化し、4残基をランダム化したペプチドライブラリーを18種類のアミノ酸を用いて合成し、N末端に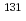 I標識が可能なD体チロシン(y)を導入したペプチドライブラリー(y(3-
I標識が可能なD体チロシン(y)を導入したペプチドライブラリー(y(3-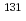 I)-A
I)-A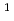 -A
-A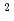 -X
-X -X
-X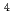 -X
-X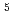 -X
-X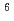 , A:固定, X:ランダム)を作製した。細胞結合実験の結果、yIIXXXX (固定位置にイソロイシンが二つ配列したライブラリー)がHER2過剰発現細胞株に高い親和性(約42%dose)を示した。一方、他のライブラリーは低い親和性(約1%dose)を示した。以上より、
, A:固定, X:ランダム)を作製した。細胞結合実験の結果、yIIXXXX (固定位置にイソロイシンが二つ配列したライブラリー)がHER2過剰発現細胞株に高い親和性(約42%dose)を示した。一方、他のライブラリーは低い親和性(約1%dose)を示した。以上より、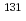 I標識ペプチドライブラリーを用いて、がん細胞に対して親和性を持つペプチドの選抜が可能であることが示唆された。
I標識ペプチドライブラリーを用いて、がん細胞に対して親和性を持つペプチドの選抜が可能であることが示唆された。
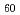
 イオン透過によるアミノ酸およびペプチドの前方二次イオン放出
イオン透過によるアミノ酸およびペプチドの前方二次イオン放出丸毛 智矢*; 中嶋 薫*; 木村 健二*; 鳴海 一雅; 齋藤 勇一
no journal, ,
単原子の一次イオンを試料に入射したときに入射側に放出される二次イオンを検出・分析する従来の二次イオン質量分析法(SIMS)では、生体試料の分析においては試料中の高分子を細かい断片にまでは壊さずに効率よくイオン化して放出させることが困難という欠点がある。そこで、本研究では、高分子二次イオンの断片化抑制と高収量化を目的として、高分子を細かく断片化せずに放出できることが期待されるクラスターイオンを一次イオンとして用いるとともに、薄膜試料において二次イオン収量がより高いと確認されている、透過一次イオンによる前方(試料下流側)での二次イオン検出を行う手法の有効性を調べた。厚さ20nmの非晶質SiN自立薄膜上に作製したアミノ酸薄膜に、SiN側から5MeV C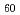
 イオンを照射したときに前方に放出される二次イオンの質量分析を行った。その結果、従来方法に比べて分子イオン収量の向上及び分子イオン断片化抑制の効果が認められ、本手法が、アミノ酸の分析に有効であることを明らかにした。講演では、さらに分子量の大きなペプチドについての結果と併せて議論する。
イオンを照射したときに前方に放出される二次イオンの質量分析を行った。その結果、従来方法に比べて分子イオン収量の向上及び分子イオン断片化抑制の効果が認められ、本手法が、アミノ酸の分析に有効であることを明らかにした。講演では、さらに分子量の大きなペプチドについての結果と併せて議論する。